Retour à la bibliothèque Romer
Les 7 péchés des essais d'OGM

L'utilisation de cultures génétiquement modifiées (GM) augmente dans le monde entier. Cette évolution offre de nombreuses opportunités à l'industrie agricole et pose de nombreux défis à l'industrie de l'analyse. Un expert de Romer Labs partage ses connaissances sur l'analyse des cultures génétiquement modifiées afin que vous puissiez éviter de commettre les erreurs les plus courantes dans votre laboratoire.
1. Identifier la mauvaise cible
Faites vos devoirs : c'est peut-être l'habitude la plus élémentaire que tout scientifique puisse prendre. C'est particulièrement nécessaire pour les essais d'organismes génétiquement modifiés (OGM), où faire ses devoirs signifie savoir quels événements constituent vos cibles afin d'éviter les faux positifs et les résultats erronés. Le problème concerne les caractères. Un caractère est une protéine dérivée d'une modification génétique qui confère une caractéristique particulière à la plante. Les modifications génétiques peuvent être présentes dans différentes combinaisons qui produisent des caractères similaires ou totalement différents. Parmi les éléments les plus populaires des modifications génétiques figurent les promoteurs (p35S, FMV), les terminateurs (NOSt), les gènes codant pour certains caractères utiles (cp4 epsps, pat, bar, Cry1A et autres) et les gènes codant pour des marqueurs sélectifs (NPTII, PMI). Vos techniciens doivent prendre en compte de nombreux facteurs différents pour définir la cible de toute analyse d'OGM. Veillez à prendre en considération le territoire d'origine du produit ainsi que les événements possibles, à savoir si ces événements sont autorisés dans la région concernée et si la plante en question possède des caractéristiques biotechnologiques disponibles dans le commerce. Cela peut s'avérer délicat : parfois, la modification existe mais n'est pas autorisée ou plantée dans certaines régions. En revanche, elle peut être largement utilisée dans une autre région. En outre, il y a eu des cas où des événements non approuvés ont échappé au confinement et se sont retrouvés sur le terrain.
2. Choisir une méthode défectueuse ou insuffisante
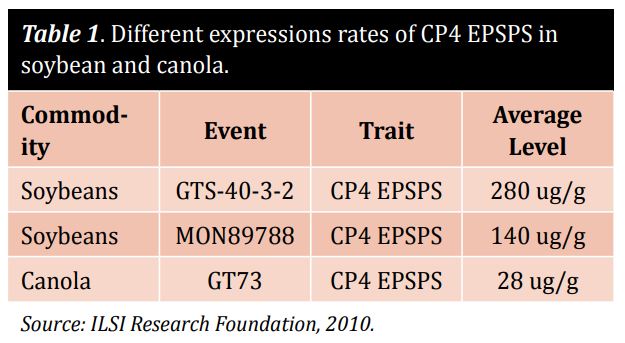
Il peut s'agir d'une décision risquée : quel doit être le champ d'application d'un dépistage d'OGM ? Les laboratoires peuvent cibler étroitement quelques éléments génétiques ou protéines, ou étendre le champ d'application à plusieurs événements ou protéines, ce qui peut s'avérer coûteux. Il est essentiel de trouver la méthode qui répond à vos besoins et qui garantit des résultats précis. Les méthodes basées sur l'ADN prennent du temps et dépendent d'une extraction d'ADN de haute qualité et de contrôles appropriés. La variation du nombre de copies et la polyploïdie peuvent également poser des problèmes dans les échantillons et doivent être prises en compte lors de l'analyse de l'ADN. L'examen de quelques plantes courantes permet d'illustrer ce point. Dans le cas du soja, il ne suffit pas de rechercher les promoteurs et les terminateurs, car seuls quelques-uns des 15 événements potentiels du soja contiennent ces éléments génétiques communs. Il en va tout autrement pour le maïs : un dépistage général de ces éléments est presque entièrement suffisant, car la plupart des événements dans le maïs contiennent ces éléments. Alors que les méthodes basées sur l'ADN sont coûteuses et utilisées uniquement dans les laboratoires d'analyse, l'identification des protéines est relativement bon marché et permet de rechercher des caractéristiques communes sur place. La majorité des plantes génétiquement modifiées ont leur propre niveau d'expression de protéines modifiées. Soyez prudent lorsque vous procédez à l'analyse des protéines du soja et du canola à l'aide des mêmes bandes du dispositif à flux latéral (DFP). Le tableau 1 met en évidence les différents taux d'expression de l'EPSPS CP4, ce qui rend nécessaire l'utilisation de différentes méthodes de détection LFD pour le soja et le colza. La bonne approche consiste à utiliser différents tests et à ajuster la sensibilité pour les différents produits afin d'atteindre un niveau de détection similaire.
3. Une compréhension insuffisante des différents degrés de sensibilité des tests
Les méthodes fondées sur l'ADN sont très sensibles et permettent de détecter une seule copie du gène cible. La sensibilité des méthodes fondées sur l'ADN est limitée par le nombre de semences testées. Elle est généralement de 0,01 % ou d'une semence génétiquement modifiée (GM) dans un ensemble de 10 000 semences non GM. Cette sensibilité est plus que suffisante pour être sûr à 99,9 % d'un niveau de détection spécifique allant jusqu'à 0,1 %. D'autre part, les méthodes basées sur les protéines ont une limite de détection (LOD) aussi basse que 0,1 %, soit 1 semence génétiquement modifiée sur 1 000 semences non génétiquement modifiées. Cette sensibilité n'est cependant pas suffisante pour garantir un résultat avec une certitude de 99 %. Le mieux que vous puissiez obtenir avec un test de protéine unique ayant une limite de détection de 0,1 % est un niveau de 0,46 % avec un niveau de confiance de 99 %. La distribution non uniforme des graines dans les échantillons réels est à l'origine de cet écart. Pour être certain à 99 % que le niveau de contamination par les OGM est inférieur à 0,1 %, nous vous recommandons d'effectuer au moins quatre tests sur 1 000 grains avec une sensibilité de 0,1 % chacun. Pour une confiance de 95 % à 0,1 %, effectuez trois tests de 1 000 grains, tous négatifs.
4. Élimination des impuretés ou traitement de l'échantillon
Les laboratoires céréaliers éliminent souvent les impuretés des échantillons avant d'effectuer un test. Toutefois, la purification des échantillons d'OGM n'est pas autorisée. Si des résidus contenant des traces de plantes OGM sont laissés dans les échantillons, ils doivent être détectés. Par exemple, si un échantillon de maïs contient des résidus de soja OGM (grains, coquilles, poussières), le lavage et le nettoyage manuel élimineront ces résidus et produiront un résultat incorrect. Ne soumettez les échantillons à aucun traitement thermique, même pour sécher l'excès d'humidité. Pour les méthodes basées sur les protéines en particulier, cela pourrait entraîner la dénaturation des protéines de trait et conduire à une perte totale de sensibilité du test, car la protéine cible aurait changé. Les anticorps utilisés dans ces applications ne pourraient alors plus reconnaître leurs cibles.
5. Utilisation d'une procédure inappropriée pour préparer l'échantillon
Votre méthode d'isolement de l'ADN doit être soigneusement conçue et suivie afin d'éviter la dégradation de l'ADN, qui pourrait fausser vos résultats. Il est donc important de vérifier la qualité et la quantité d'ADN purifié. Outre les réactifs d'extraction d'ADN utilisés, la méthode de broyage est également très importante. Les moulins à lames donnent les meilleurs résultats, car ils broient suffisamment finement pour permettre l'extraction de l'ADN. Toutefois, il est impératif de nettoyer soigneusement tout équipement de broyage après utilisation, car la contamination croisée est un problème majeur dans les essais d'OGM. Un équipement qui n'est pas correctement nettoyé peut produire des résultats faussement négatifs dans les lots suivants. L'extraction des protéines nécessite un broyage plus grossier. Il suffit d'écraser toutes les graines de l'échantillon. Si vous broyez les graines trop finement, l'extrait mettra trop de temps à se déposer et l'échantillon contiendra trop de particules solides, qui se colleront aux LFD et empêcheront l'écoulement du liquide. Les moulins utilisés pour l'extraction avant l'analyse LFD doivent être réglés de manière à éviter de produire des fractions trop fines. La forme du récipient d'extraction doit également être prise en compte : il ne doit pas être plat et il est préférable d'utiliser des récipients jetables pour éviter la contamination croisée. Les mixeurs sont très souvent utilisés pour le broyage en vue de l'analyse des protéines car ils sont très faciles à nettoyer, ce qui permet d'éviter les problèmes de contamination croisée.
6. Personnaliser les procédures de test ou ne pas lire la notice d'emballage
Il pourrait bien s'agir de la faute la plus grave commise par les opérateurs. Alors que les laboratoires d'analyse de référence emploient du personnel formé tout au long de l'année, les laboratoires céréaliers ont souvent une politique d'emploi saisonnier et emploient donc du personnel moins compétent en matière d'analyse. Cela peut conduire à ce que la procédure d'essai soit mal lue, mal suivie ou modifiée dans le laboratoire. Cela peut affecter toutes les parties du processus de test, en commençant par l'extraction et en affectant les éléments de test tels que les volumes de liquide requis pour le test, les temps de développement et les procédures d'analyse. Veillez à lire attentivement l'emballage et la documentation avant d'effectuer toute analyse afin de garantir la fiabilité des résultats.
7. Nettoyage insuffisant de votre équipement (entraînant une contamination croisée)
Veillez à ce que le moulin que vous utilisez pour l'analyse des OGM soit facile à nettoyer. Le mieux est d'utiliser des bocaux et des lames amovibles afin de pouvoir les nettoyer séparément du moteur du moulin. Chaque élément de votre équipement doit être lavable. Les mixeurs sont couramment utilisés pour broyer les échantillons d'OGM car ils sont faciles à nettoyer. Les moulins doivent être démontés et toutes les pièces doivent être lavées séparément. Lavez tout le matériel avec du savon liquide et rincez ensuite à l'eau. N'utilisez pas d'éthanol comme agent de nettoyage ; il sert uniquement à accélérer le processus de séchage. Chaque laboratoire doit valider sa procédure de nettoyage pour en garantir l'efficacité. Nous recommandons l'utilisation de gants pour la manipulation de tous les échantillons. Le fait de changer de gants et de se laver les mains entre chaque échantillon permet également d'éviter la contamination croisée. Veillez à nettoyer tous les outils qui ont pu entrer en contact avec l'extrait de matière broyée. Une autre solution consiste à utiliser autant que possible du matériel jetable.
Publié le :
OGM