Wie man eine LC-MS/MS-basierte Multi-Mykotoxin-Methode entwickelt

Häufig sind Getreidekulturen und Rohstoffe mit mehr als einem Mykotoxin kontaminiert. Romer Labs entwickelt eine einzige Methode, die mehrere Mykotoxine gleichzeitig nachweisen kann. Irene Hahn beschreibt wie.
Es gibt etwa 400 Verbindungen mit niedrigem Molekulargewicht, die als Mykotoxine anerkannt sind und jeweils unterschiedliche toxische Wirkungen für Mensch und Tier haben. Die hohe Anzahl möglicher Verunreinigungen sowie wiederholte Berichte über das gleichzeitige Auftreten von Mykotoxinen machen es erforderlich, geeignete Nachweismethoden zu entwickeln, wie z.B. Flüssigchromatographie-Massenspektrometrie (LC-MS/MS)-basierte Multi-Mykotoxin-Methoden, um mehrere Mykotoxine gleichzeitig zu analysieren. Die Entwicklung solcher Methoden ist eine Herausforderung, da die Einbeziehung mehrerer Toxine mit unterschiedlichen chemischen Eigenschaften in einer Analyse bedeutet, dass bei der Wahl der optimalen Methodenparameter Kompromisse eingegangen werden müssen.
Veröffentlicht am:
Mykotoxin
Dieser Artikel wurde in Spot On #5 veröffentlicht.
Sind Sie neugierig, was Spot On zu bieten hat?
Magazin aufrufen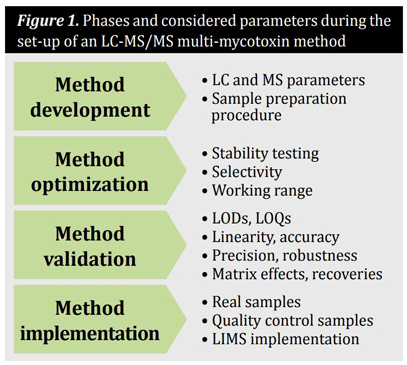
Analyse von Mykotoxinen auf der Grundlage von LC-MS/MS
Analysemethoden, die auf Umkehrphasen-LC gekoppelt mit MS (LC-MS/MS) basieren, haben sich in den letzten zehn Jahren zu einer leistungsstarken und modernen Technik für die qualitative und quantitative Analyse von Mykotoxinen entwickelt. Die Vorteile dieser Methode sind die hohe Empfindlichkeit und Selektivität, die Anwendung auf die Analyse mehrerer Mykotoxine sowie die Bereitstellung zusätzlicher Informationen über das Masse-Ladungs-Verhältnis (m/z) und die Fragment-Ionen der untersuchten Analyten. Derzeit gibt es einen starken Trend zur Anwendung von Multi-Mykotoxin-Methoden, die durch LC-MS/MS erreicht werden. Mit dieser Technik kann eine breite Palette von Mykotoxinen, die zu verschiedenen chemischen Familien gehören, in einer einzigen Messung gleichzeitig bestimmt werden. Allerdings stellen Probleme wie die chemische Vielfalt der Verbindungen selbst, das breite Spektrum der getesteten landwirtschaftlichen Erzeugnisse, die unterschiedlichen Konzentrationsbereiche und die unterschiedliche Verteilung des Vorkommens eine Herausforderung für die Methodenentwicklung und -optimierung dar. Daher müssen bei der Wahl des Extraktionslösungsmittels und der mobilen Phase Kompromisse eingegangen werden, und die Bedingungen können für bestimmte Analyten, zu denen saure (Fumonisine), basische (Mutterkornalkaloide) sowie polare (Moniliformin, Nivalenol) und apolare Verbindungen (Zearalenon, Beauvericin) gehören, alles andere als optimal sein. Darüber hinaus führt das Fehlen geeigneter kommerziell verfügbarer Analysestandards für bestimmte Analyten dazu, dass nur qualitative Screening-Aussagen statt quantitativer Ergebnisse gemacht werden können.
Entwicklung einer Multi-Mykotoxin LC-MS/MS Methode
Im Allgemeinen bestehen Methoden zur Quantifizierung von Mykotoxinen in Getreide und Getreideprodukten aus einer repräsentativen Probenahme, der optimierten Probenvorbereitung und einem Reinigungsschritt sowie der Analysetechnik einschließlich Trennung und Detektion.Der Aufbau einer Multi-Mykotoxin-Methode auf der Basis von LC-MS/MS folgt in der Regel einem vierstufigen Prozess. Diese und die berücksichtigten Parameter sind in Abbildung 1 zusammengefasst. Während der Methodenentwicklung und -optimierung haben die Parameter einen erheblichen Einfluss auf die Qualität und Zuverlässigkeit der Ergebnisse und sollten daher sorgfältig bewertet werden. Zu diesem Zweck müssen analytische Standards für jede Verbindung mit der angegebenen Reinheit verwendet werden. Für bestimmte Analyten sind jedoch keine analytischen Standards im Handel erhältlich. In diesen Fällen könnte es möglich sein, auf Standards zuzugreifen, die noch erforscht werden, oder mit verfügbarem Material zu arbeiten, das weniger gut charakterisiert ist.

Methodenentwicklung
Während der Entwicklung einer LC-MS/MS-basierten Methode müssen die MS- und LC-Parameter sowie das Verfahren zur Probenvorbereitung ausgearbeitet werden. Für die Optimierung der MS-Parameter sollte jede Verbindung als reiner analytischer Standard direkt in das Massenspektrometer injiziert werden. Anschließend müssen der ideale Ionisierungsmodus (positiv oder negativ), die am häufigsten vorkommenden Vorläufer- und Produktionen sowie die idealen Entstaubungspotentiale, Kollisionsenergien und Ausgangspotentiale der Kollisionszellen evaluiert werden. Bei der Optimierung der LC-Parameter müssen die idealen mobilen Phasen und Gradienten sowie die optimale chromatographische Säule evaluiert werden. Die Methode der Wahl für die Probenvorbereitung bei der Analyse mehrerer Mykotoxine ist ein Dilute-and-Shoot-Ansatz ohne jegliche Probenreinigung, um das Mykotoxinmuster während der Probenvorbereitung nicht zu verfälschen. So ist eine Reinigung (z.B. Festphasenextraktion), die keinen der gewünschten Analyten unterdrückt, nur selten verfügbar. Wird jedoch kein Cleanup verwendet, können koeluierende und störende Matrixkomponenten die Ionisierungseffizienz der Zielanalyten beeinträchtigen, was zu einer schlechteren Wiederholbarkeit und geringeren Genauigkeit führt. Daher ist die Bestimmung und Kompensation solcher Matrixeffekte unerlässlich. Dies kann durch die Bestimmung der scheinbaren Wiederfindung und die anschließende Korrektur der Ergebnisse mit diesem Wert, durch eine matrixangepasste Kalibrierung oder durch die Verwendung von isotopenmarkierten internen Standards erreicht werden. Letzteres führt zu Ergebnissen mit höchster Genauigkeit und Zuverlässigkeit, jedoch mit minimalem Zeit- und Kostenaufwand.
Optimierung der Methode
Die Optimierung der Analysemethode umfasst Stabilitätsprüfungen der Analyten in Standardlösungen und Proben sowie den Nachweis der Selektivität und die Bestimmung des Arbeitsbereichs.
Methodenvalidierung
Die Methodenvalidierung ist eine Voraussetzung für die Erzielung zuverlässiger Ergebnisse in Bezug auf Vergleichbarkeit und Rückverfolgbarkeit. Die Methodenvalidierung muss für jeden Zielanalyten in allen erforderlichen Matrices separat durchgeführt werden. Typische Leistungsmerkmale, die bei der Validierung einer quantitativen Methode bewertet werden sollten, sind Nachweisgrenzen (LOD), Bestimmungsgrenzen (LOQ), Linearität, Präzision, Selektivität, Robustheit, Genauigkeit, Matrixeffekte und Wiederfindungen. Die Validierung der Methode kann durch Aufstocken von Leerproben mit jedem erforderlichen Analyten in einer Reihe von Konzentrationen in Wiederholung durchgeführt werden. Wenn verfügbar, sollte die Richtigkeit der Methode mit zertifizierten Referenzmaterialien bestätigt werden. Darüber hinaus ermöglichen matrixangepasste Materialien und die Teilnahme an Leistungstests eine zusätzliche Qualitätssicherung. Die begrenzte Anzahl von Referenzmaterialien ist unter anderem für den semi-quantitativen Charakter solcher Screening-Methoden verantwortlich. Obwohl Multitoxin-Methoden bereits in der Routineanalytik eingesetzt werden, müssen die hohen Investitions- und Wartungskosten berücksichtigt werden.
Implementierung der Methode
Bei der Implementierung sollten sowohl reale Proben als auch Qualitätskontrollproben mit der validierten Methode gemessen werden. Darüber hinaus sollte die validierte Methode in Routinelaboratorien implementiert und verwendet werden, was im Hinblick auf die Verfügbarkeit von Laborpersonal und Instrumenten schwierig sein kann.
Allgemeine Herausforderungen bei der Bestimmung von Mykotoxinen
In der Regel sind Mykotoxinkontaminationen in landwirtschaftlichen Kulturen heterogen verteilt und können sich in 'Hot Spots' konzentrieren. Daher ist die Probenahme ein wichtiger und entscheidender Schritt, da eine repräsentative Probe für die präzise und genaue Bestimmung des Mykotoxingehalts unerlässlich ist. Mit den meisten Analysetechniken ist ein direkter Nachweis von Mykotoxinen in gemahlenen Getreideproben nicht möglich, weshalb Probenvorbereitungsverfahren erforderlich sind.
Ein weiterer wichtiger Schritt ist die Extraktion der Proben. Bei einer herkömmlichen Fest-Flüssig-Extraktion werden Mykotoxine aus gemahlenen Getreideproben durch mechanisches Schütteln mit verschiedenen Mischungen von Lösungsmitteln (wässrig und organisch), manchmal auch mit sauren oder alkalischen Modifikatoren, extrahiert. Die resultierenden Extrakte können dann für die Analyse weiterverwendet werden. Die meisten der für regulatorische und wissenschaftliche Zwecke entwickelten Analysemethoden basieren auf der chromatographischen Trennung, hauptsächlich der Flüssigkeitschromatographie (LC), in Kombination mit einer Vielzahl von Detektoren. LC-Detektoren für die kontinuierliche Überwachung und den Nachweis von Analyten, die aus der chromatographischen Säule eluieren, basieren auf Messungen der UV/Vis-Absorption, Fluoreszenz und Massenspektrometrie (MS). Aufgrund der unterschiedlichen chemischen und physikochemischen Eigenschaften von Mykotoxinen wurden die meisten dieser Analysemethoden für eine Zielverbindung oder bestenfalls für eine Gruppe eng verwandter Mykotoxine optimiert. Darüber hinaus umfassen diese zielgerichteten Methoden häufig Extraktions- und Reinigungsschritte, um unerwünschte Matrixkomponenten zu reduzieren oder zu eliminieren. Daher hängt die generierte Vorkommensabschätzung immer von den analysierten Proben sowie den Mykotoxinen ab, die mit den verwendeten Analysemethoden erfasst werden.
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass die Entwicklung einer auf LC-MS/MS basierenden Multi-Mykotoxin-Methode eine Herausforderung darstellt, wenn es darum geht, zuverlässige und vergleichbare quantitative Daten zu erhalten. Eine große Anzahl verschiedener Parameter, die die Qualität und Zuverlässigkeit der Ergebnisse erheblich beeinflussen, muss für jeden Analyten in jeder Matrix gesondert sorgfältig berücksichtigt werden. Darüber hinaus bedeutet die chemische Vielfalt der Mykotoxine, dass bei der Methodenentwicklung Kompromisse eingegangen werden müssen, die für bestimmte Analyten alles andere als optimal sein können. Darüber hinaus stellen die große Bandbreite an landwirtschaftlichen Rohstoffen sowie die unterschiedlichen Konzentrationsbereiche und die unterschiedliche Verteilung des Vorkommens eine weitere Herausforderung für die Methodenentwicklung und -optimierung dar. Nichtsdestotrotz ist die Entwicklung von Multi-Mykotoxin-Methoden zweifellos erforderlich und Fortschritte in dieser Technologie werden ihre Anwendung weiter ausweiten.